糖尿病、高血壓與腦血管鈣化組合下的中風風險進程:應用 VMT 能量模型
(報告編號 1355,2025/9/13)
Gerald C. Hsu
EclaireMD 基金會
類別:中風
前言
我想分享我的中風如何源自超過三十年的腦血管鈣化逐步累積,以及我如何在過去 14 年中使用黏塑性能量模型(VMT)追蹤其軌跡。
我在 45 歲(1992 年)被診斷為第二型糖尿病(T2D)。在最初的二十年裡,控制不佳 —— 我的 HbA1c 曾達 11%。長期高血糖緩慢而持續地損害血管,包括腦內血管。在 47 歲(1994)到 56 歲(2003)之間,我經歷了五次心血管事件,這些都是動脈承受巨大壓力的明顯警訊。
慢性高血糖的病理機轉已被廣泛證實。持續的高血糖會促進內皮功能障礙、動脈僵硬與動脈粥樣硬化加速。晚期糖基化終產物(AGEs)累積並與血管壁的膠原蛋白與彈性蛋白交聯,降低血管彈性。高血糖也會啟動氧化壓力路徑,產生活性氧,直接傷害內皮細胞。此外,第二型糖尿病常伴隨慢性低度發炎與血脂異常,進一步動搖血管完整性。這些機制合力使小動脈與中動脈逐步受損,並在血管壁內沉積鈣質。
到了 63 歲(2010 年),我終於透過生活方式管理將糖尿病嚴格控制。過去 11 年(2015–2025),我的 HbA1c 維持在安全範圍(5.9–6.8%),且未使用藥物。然而,早期二十年的損害已在血管系統中留下深刻痕跡。同期我也出現嚴重腎病(CKD)、神經病變與視網膜病變——這些都證明了全身大、小血管已遭受損害。
老化一直是背景性的推手。隨著年齡增加,血管自然失去彈性並僵硬——我的年均脈壓(PP)自 2012 年後超過 40 mmHg,2024 年接近 50 mmHg——這些情況有利於鈣化發展。老化改變彈性蛋白與膠原蛋白的組成;慢性腎病擾亂鈣磷代謝,兩者皆加速血管鈣化。血脂異常(糖尿病常見)則助長動脈粥樣硬化與血管發炎。
高血壓則為這一過程加上另一層壓力。持續的高血壓會使動脈壁增厚、提升剪應力並加速鈣化。在我的個案中,我並未被正式診斷為慢性高血壓,這起初看似與影像中顯示的高血壓型鈣化相矛盾。
答案在於現代醫學所稱的 「隱匿性高血壓(masked hypertension)」或「間歇性血壓激增(episodic surges)」。許多糖尿病患者會在夜間、清晨或情緒壓力期間出現血壓升高。運動後也可能出現急性高血壓,尤其在血管僵硬或已有小血管病變者,血壓可能急遽上升並長時間維持較高值。由於血壓波屬高頻波,這些短暫飆升在門診常被漏測,但可透過 24 小時動態血壓監測發現。研究顯示,這些暫時性激增並非良性——它們會對脆弱的小動脈造成機械性損傷,特別是在自我調節能力敏感的腦部。數十年間,這些短暫衝擊的累積傷害,可與持續性高血壓造成的損害等量齊觀。在我這裡,它們成為加速劑,與糖尿病與老化造成的損害相互疊加;而我不良的血脂狀態又進一步惡化了這些負荷。
回顧來看,糖尿病是導致我腦血管鈣化的主要驅動因子;老化則是持續的背景因素;間歇性血壓激增雖為次要因素,但配合低頻且強大的血糖波,足以把已受損的血管推向臨界並導致在 2025 年 6 月 21 日發生的第一次中風。
影像學證據:CT 與 MRI
我的 CT 掃描顯示數處腦內小血管沿線有零散的亮白沉積——為血管鈣化的典型徵象。CT 是檢視鈣化的首選影像工具,因其能以極高靈敏度偵測高密度沉積。
MRI 雖然不直接顯示鈣質,但呈現其後果:白質高訊號(white matter hyper-intensities)、小腔隙性梗塞(small lacunar infarcts)以及慢性微血管疾病的影像特徵。這些所見與文獻中所稱的 腦小血管病(CSVD) 相符,CSVD 是老年人缺血性與出血性中風的重要原因之一。
放射科醫師常將這些發現歸因於慢性高血壓;然而,我的案例顯示,長期糖尿病與老化同樣能產生幾乎無法區別的影像特徵。
整合工程與醫學
2025 年 9 月 11 日,在第一次中風後的追蹤會診中,我與神經科醫師一起檢視 CT 與 MRI 影像。那一刻我首次清楚看見導致出血性中風的根本原因:並非單一瞬間的觸發,而是超過三十年的第二型糖尿病、老化、間歇性急性高血壓與腦小血管鈣化的累積結果。
這個認知立刻讓我回想起 1972 年在 MIT Norman Jones 教授課堂上所學的工程觀念——結構在嚴重動態載荷下展現的非線性塑性反應。五十年後,我把當年的工程原理用來理解我當前的醫學情況。
從科學角度看,我的案例是慢性疾病 非線性、動態、不可逆且累積性 的典型示例。傳統醫學常用單一時間點的指標來評估風險(例如 HbA1c、收縮壓、LDL),然而血管鈣化並非單一檢驗或一次門診的結果,而是數十年多重壓力(生化、血流動力學、代謝)交互作用的不可逆產物。只要擁有足夠的縱向數據,這種累積效應即可用 黏塑性能量模型(VMT) 清楚呈現。
從個人角度看,我現在知道這場中風並非單純的「倒楣」。它是血管承受超過 30 年壓力的可預見結果。儘管過去 15 年我努力將糖尿病控制得更好,但早年 20 年的傷害仍深植血管。CT 上的鈣化,實際上是過去生理狀態留下的「疤痕」。
資料準備(Data Preparation)
我自 2010 年起開始蒐集個人健康資料(涵蓋生活型態因子與主要生物標記)。不過,資料在 2012–2013 年後才達到足夠完整的程度。此外,許多生物標記需要醫師處方才能檢測,因而限制了數據的蒐集範圍。因此,本次分析主要基於 2012 年後較為完整的資料集。
針對本次以三類(糖尿病、高血壓、血管鈣化)評估中風風險的研究,我建立了以下三個方程式:
糖尿病(第二型)風險
= ((FPG / 90) + (eAG / 120)) / 2
註:FPG = 空腹血漿葡萄糖(fasting plasma glucose);
eAG = 估算平均血糖(estimated average glucose)。
高血壓(HT)風險
= ((高收縮壓 / 140) + (脈壓 / 45)) / 2
註:高收縮壓(High SBP)代表超過生理基準的收縮壓值;脈壓(PP)= 收縮壓 – 舒張壓,是血管硬化與老化的指標。
鈣化風險(Calcification Risk)
= (實際年齡 / 70 + 正規化血脂) / 2
註:實際年齡(Real Age)用於標準化年齡效應;正規化血脂(Normalized Lipids)為將血脂數據標準化後的指標。
結果解釋(Results Interpretation)
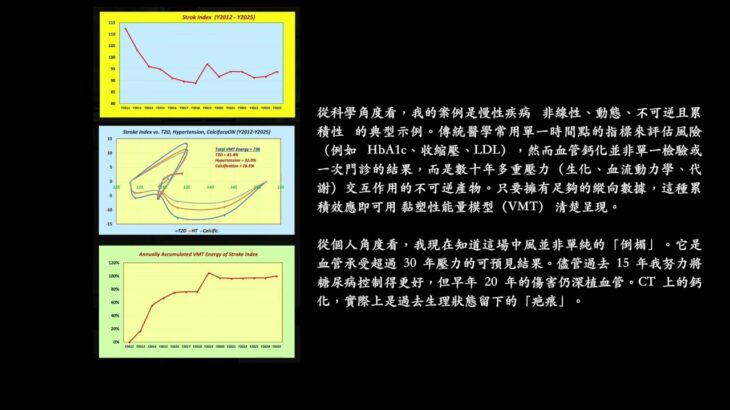
1. 中風指數軌跡(2012–2025)
• 2012 年中風指數非常高(152),反映當時糖尿病失控、具有高血壓風險與鈣化風險。
• 到 2016–2018 年,指數降至約 89–90,顯示糖尿病控制與血壓穩定獲得改善。
• 2019 年反彈至 97,之後在 2020–2025 年間持續盤整於 91–94。
• 整體而言,中風指數由 152 改善約 38%(降至約 94),但由於不可逆的鈣化,指數從未回復到正常水平。
2. VMT 應力—應變能量貢獻(VMT Stress–Strain Energy Contributions)
• 累積總 VMT 能量 = 736 單位。
• 相對 VMT 能量貢獻比重:
o 第二型糖尿病(T2D):41.4%
o 高血壓(Hypertension):32.0%
o 鈣化(Calcification):26.6%
• 解讀:糖尿病為主要驅動因子(約 41%),但高血壓與鈣化合計約占 59% 的血管應力,與臨床病史相符。
3. 累積 VMT 能量進展(Cumulative VMT Energy Progression)
• 2012–2014:急速上升至 56%,反映早年數十年的糖尿病失控所留的傷痕。
• 2015–2017:盤整於約 70%,因為血糖控制改善而穩定下來。
• 2018–2019:跳升至 100%,與血管鈣化與間歇性高血壓事件相對應。
• 2020–2025:維持於約 97–100%,顯示損害已達飽和,後續進展有限。
摘要:大部分血管損害在 2019 年前已累積完成。2020 年後的生活方式與糖尿病控制降低了惡化速率,但鈣化已鎖定了一個持續存在的基線中風風險。
結論
這項 14 年的縱向研究顯示,中風風險非源自單一因素,而是糖尿病、高血壓與血管鈣化之間累積交互作用的產物。即便自 2010 年以來我已嚴格控制血糖並在 2020 年後維持穩定管理,由早期數十年造成的不可逆鈣化仍使中風風險持續偏高。
從工程與醫學系統觀點,我的案例突顯慢性血管損傷的 非線性、動態與不可逆性。也強調了早期介入的重要性:晚期控制雖能穩定進展,但無法抹除早年已造成的數十年傷害。
對患者與研究者而言,關鍵教訓是中風預防不僅需要即時生物標記監測,更需要縱向地建模累積應力(如 VMT 能量框架)來掌握整體風險。
若將這份量化研究與其他已發表的中風研究比較,我的工作不僅納入病理生理的解釋,也超越傳統相關性統計,展現因果途徑、累積的非線性效應與不可逆損傷,採系統性觀點,讓研究既具科學價值也具個人體驗的真實性。
附錄:VMT 方法論(VMT Methodology)
黏塑性能量模型(VMT)使用來自工程材料科學的應力—應變原則,量化慢性疾病的進展。
• 應變(Strain):代表觀察到的健康結果(例如中風指數)。
• 應力來源(Stressors):代表促成風險的因子或影響輸入(例如 T2D、高血壓、鈣化)。
• 能量(Energy):計算為應力—應變曲線下方隨時間累積的面積,反映系統的累積且不可逆損傷。
• 該模型捕捉非線性、動態與不可逆行為,這些是傳統線性統計無法反映的。
本研究將三類應力源標準化為生理基準來量化:
1. 糖尿病(FPG、eAG)
2. 高血壓(SBP、PP)
3. 鈣化(年齡、血脂)
使用 2012–2025 年的縱向數據集,得以量化年度與累積能量貢獻,並揭示飽和效應與主導應力源。
欲了解更多細節,請搜尋 YouTube 頻道 Health Talk with EclaireMD。
http://www.youtube.com/watch?v=_UIuvrIO60Ik
免責聲明
本內容僅供教育參考,並非醫療建議。本文未建立醫病關係。您可以自由分享本摘要,但不得修改或以您名義重新發表。